
英语原文共 3 页,剩余内容已隐藏,支付完成后下载完整资料
本科实验室的生物分析实验:运动饮料中的葡萄糖监测
J·贾斯汀·古丁,杨文荣,马尼海尔·西图摩朗
澳大利亚,新南威尔士州2052,悉尼,新南威尔士大学化学院*justin.gooding@unsw.edu.au
在新南威尔士大学,学生们在最后一学年可以选修一门课程,叫做生物系统中的化学。这门课程重点从现代化学角度来向学生们讲解生物学,不论是合成或分析生物分子、制作生物分子功能的分子,还是合成生物活性分子。课程的一部分涉及生物分子在分析化学中的应用,即生物分析化学。想要选修本课程的学生必须已经完成了最后一年的分析化学课程,同时熟悉多种传统的定量分析法。生物分析化学的学科目的在于通过建立生物识别与一些信号传导的方法之间的联系,利用生物分子的非正常特异性来分析靶标分子。以上可以通过进行生物测定和生物传感器来获得。生物分析化学的巨大优势在于,某些情况下,由于生物识别分子的特异性,可以在不进行样品制备的情况下分析如体液和食物这类复杂样本。
生物分析化学的教学需要在条件相当的实验室进行,这表明了分析复杂样本的容易度,同时说明在相关技术上还存在缺点。然而,目前本科实验班缺乏生物分析实验文献。目前所有的要么是已经进行了免疫测定实验(1,2),要么是对酶电极使用的概述(3-8)。令人惊讶的是,尽管已经有了生物化学下的可溶性酶分析实验(参见pope等人极其参考文献,9),我们本科阶段并没有任何关于溶液酶测定的分析实验。
本文介绍了我们为大四生开发的两个互补的生物分析实验,每一个都可以在三个小时的实验课上完成。第一个是关于使用基于溶液的酶分析来分析运动饮料中的葡萄糖浓度。第二个实验中,对相同溶液使用酶电极进行分析。未公布运动饮料的来源,因为瓶子上的标签显示饮料中不仅有一种糖(通常是蔗糖和葡萄糖),而且因为它们频频在媒体上闪现,激发了学生对于分析的兴趣。 两种实验都依赖于葡萄糖氧化酶对具有高度特异性的beta;-D-葡萄糖的反应能力。我们向学生强调,即使饮料中成分复杂,葡萄糖转化酶几乎可以与beta;-D-葡萄糖完全反应。
实验一:葡萄糖溶液酶分析
本实验中使用的酶测定法是一个用于对测定葡糖糖氧化酶活性进行标准测定的变体(10)。该测定通过葡萄糖氧化酶对beta;-D-葡萄糖与同辣根过氧化物酶发生反应的第二酶进行耦合氧化反应,如下所述:
GOx
-D-glucose O2 -D-gluconolactone H2O2 (1)
HRP
H2O2 ferrocyanide H2O ferricyanide (2)
通过光谱监测第二次酶反应中铁氰化钾的产物来确定反应1的区间,并由此测定葡萄糖的浓度。在通常的葡萄糖测定法中,使用亚铁氰化钾代替高度致癌的邻联茴香胺来显色,是一个很重要的变化。亚铁氰化钾更安全、便宜、易得。实验所需设备不过是紫外可见分光光度计、比色杯、微量吸管和容量瓶。整个实验中花费最高的是酶。
在实验中,学生建立了0至0.6 mM葡萄糖之间的校正曲线。接下来每组学生对两份未知溶液进行三次测量,一个是运动饮料一个是普通饮料(不含酒精)。在分析这两种溶液时,希望学生能够找到合适的稀释值。
汇总各组的校准曲线组成一个可重现量值。我们发现各组校准曲线间的差异小于10%。这种良好的组间协定突出了教学分析的鲁棒性。当由同一名学生进行重复分析时,组内相对标准偏差约为3%。
在开展这些实验之前,为了让分析前的准备不那么复杂,需要向学生讲解生物分析法的潜在优势——溶液分析是一个很好的选择,容易执行、可靠性高。从之前课程的相关实验中,学生们已经分析了其他食物,对那些更复杂的样品准备步骤较为熟悉,例如分析牛奶中的钙所需的样品,所以当他们发现对酶进行测定是多么简单的时候都十分惊讶。
实验2:酶生物传感器
接下来的一周通过酶电极的制造来进行溶液测定实验。酶电极仅限于单一酶和葡萄糖氧化酶。样品中的葡萄糖浓度由在之前在反应1中产生的氧化后的过氧化氢从电化学的角度决定。为此,葡萄糖转化酶被简单的卡在透析膜后固定在铂电极上。该实验所需的专门设备是一个具有铂工作电极的稳压器、通常的参考电极和辅助电极。
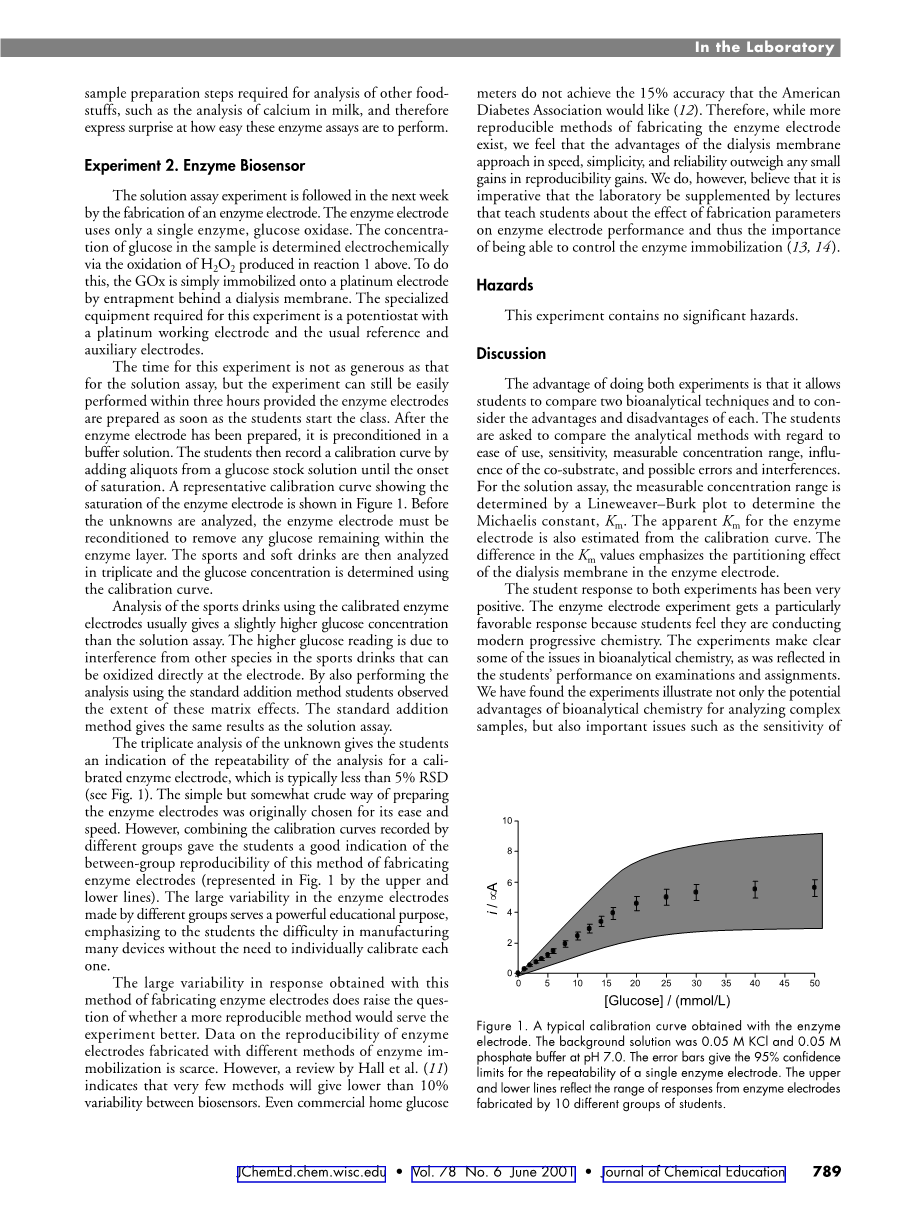
该实验不想溶液测定那样时间充裕。但是只要学生一上课就把酶电极准备好,实验就可以在3小时内完成。将酶电极制备完毕后放入缓冲液中进行预处理。接下来,学生向葡萄糖溶液中持续加入等分试样直至饱和,并记录校准曲线。显示酶电极饱和度的代表性校准曲线如图1所示。在分析未知溶液之前,必须进一步调整酶电极,务必除去酶层内剩余的所有葡萄糖。对运动饮料和普通饮料(不含酒精)进行三次测析,使用校准曲线确定葡萄糖浓度。
用校准的酶电极分析运动音量通常获取一个比测定溶液稍高的葡萄糖浓度,这是收到了运动饮料中其他可以直接进行电极氧化的成分的干扰。同样对学生观察到的矩阵效应区间使用标准添加法进行分析。标准添加法得到的结果与溶液测定相同。
对未知溶液展开的三重分析给学生一个校准酶电极反复性分析的指向,通常相对标准偏差小于5%(见图1)。选择这个简易但是有些粗略的制备酶电极的方式,最初是为了简便和迅速。然而,将不同组记录的校准曲线进行组合,为学生提供了这种制造酶电极的方法的组间反复性的良好指向有效指向(由图1中上、下线显示)。由于明显的教育目的,不同组之间制作的酶电极具有较大的差异性,这表明学生不需要挨个校准,制作很多设备是困难的。用这种发放制造酶电极获得的结果存在巨大的差异性,这也提出了一个问题:是否存在更好的为实验服务的方法。关于用不同的酶活化方法制备的酶电极的反复性的数据很少。然而,根据摩尔等人(11)的综述,有几个方法可以将生物传感器之间的差异降到10%以下。甚至市场上的家用血糖仪都难以达到美国糖尿病协会所要求的15%的准确度(12)。因此,虽然还有方法在制造酶电极方面更可再生,但我们认为透析膜制造法在速度、简易性和可靠性方面的优势超过了可再生产生的任何小的收益。然而,我们认为必须有讲师在实验室进行相关辅导,教导学生制造参数对酶电极性能的影响以及这些影响对控制固定化酶的重要性(13,14)。
危害:无明显危害。
论述
这两个实验允许学生比较两种生物分析技术,并考虑每种技术的优点和缺点,这是它们的优势之所在。要求学生从分析方法是否易于使用、灵敏度、可测量的浓度区间、共基质的影响以及课程产生的误差和干扰等方面展开比较。溶液测定的可测量浓度区间由双倒数方程决定的米氏常数KM来确定,酶电极中的表现值KM也有校准曲线进行估算。KM值的差异表明了透析膜在酶电极中的分割效果。
学生对两个实验的反响都很好,尤其是酶电极实验,因为学生觉得他们是在进行现代化学实验。实验揭露了生物分析化学中的一些问题,我们可以从学生在考试和作业中的表现窥得一二。我们发现这些实验不仅说明了生物分析化学在分析复杂样品中的潜在优势,而且还说明诸如生物分子的敏感性、质量传递在指示反应中的作用,以及从经验丰富的实验室操作员到现场工作人员采取的分析技术的困难之类的重要问题。
图1,用酶电极获得的典型校准曲线。背景溶液为0.05 M氯化钾和0.05 M磷酸盐,缓冲液pH值为7。误差栏给出了单个酶电极反复性的95%的置信区间。上,下线反映了由10个不同的学生群体制备的酶电极的响应区间。
补充
JCE Online在本期刊载了导师的注解和学生的详细背景信息和说明。
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[28535],资料为PDF文档或Word文档,PDF文档可免费转换为Word


